
本文綜述了溶血磷脂在健康與疾病中的新興作用,重點探討了其生物學功能、代謝機制及相關蛋白的作用,并評估了其在多器官系統中的潛在影響。
1.溶血磷脂酰膽堿
(Lysophosphatidylcholine, LPC)
溶血磷脂酰膽堿(LPC)是血液中最豐富的溶血磷脂,健康個體的血漿中LPC水平可高達150-500μM,在高血脂患者中可達到毫摩爾(mM)水平。LPC可攜帶飽和或不飽和脂肪酸,主要連接在sn-1位,其濃度是sn-2異構體的九倍。血漿中主要的LPC類型包括LPC16:0、LPC18:1、LPC20:4 和LPC22:6,占總LPC的90%以上。LPC主要來源于肝臟,原代小鼠肝細胞可將 LPC 分泌到培養基中,添加白蛋白可促進其分泌。LPC也可由LCAT(卵磷脂膽固醇酰基轉移酶)催化生成,或由PLA1/PLA2水解膜上的PC生成;此外,內皮脂肪酶(EL)也可通過水解HDL中的PC產生LPC。血漿中的 LPC 主要與白蛋白結合,少量存在于脂蛋白、紅細胞和血小板中。
溶血磷脂酰膽堿生理作用
發育與功能:LPC被認為是腦生長的重要因子,特別是在脂肪酸遞送過程中發揮關鍵作用。研究表明,MFSD2A(主要促進劑超家族結構域包含蛋白2A)是LPC的關鍵轉運蛋白,負責將必需脂肪酸(如DHA,二十二碳六烯酸)運輸到大腦。缺乏MFSD2A會導致腦內必需脂肪酸水平降低,從而影響神經元的膜合成和髓鞘形成。此外,LPC還通過抑制SREBP1/2通路調控新生脂肪酸的合成,表明大腦優先利用LPC攜帶的必需脂肪酸以支持正常發育。
炎癥與免疫調節:LPC具有促炎和抗炎雙重作用,其具體效應取決于其生化結構和環境。例如,LPC可以通過誘導細胞黏附分子表達來促進炎癥反應。然而,在某些情況下,LPC也可能表現出抗炎特性,例如含有DHA的LPC在sn-1位置時顯示出抗炎效果。此外,LPC還能通過G2A受體調節免疫反應。
血管功能與疾病:LPC在血管系統中具有復雜的作用。一方面,它能夠通過抑制乙酰膽堿介導的血管舒張而損害主動脈功能。另一方面,LPC還參與了動脈粥樣硬化的發病機制,包括單核細胞遷移和細胞因子表達的誘導。此外,高水平的LPC會加劇氧化應激,導致內皮細胞損傷,從而促進心血管疾病的發展。
作為信號分子:LPC不僅是結構脂質,還是一種重要的信號分子。例如,LPC可以激活特定的GPCR(G蛋白偶聯受體),如G2A和LPAR1,從而調節細胞行為。此外,LPC還可能通過其他未知受體參與鈣信號傳導。
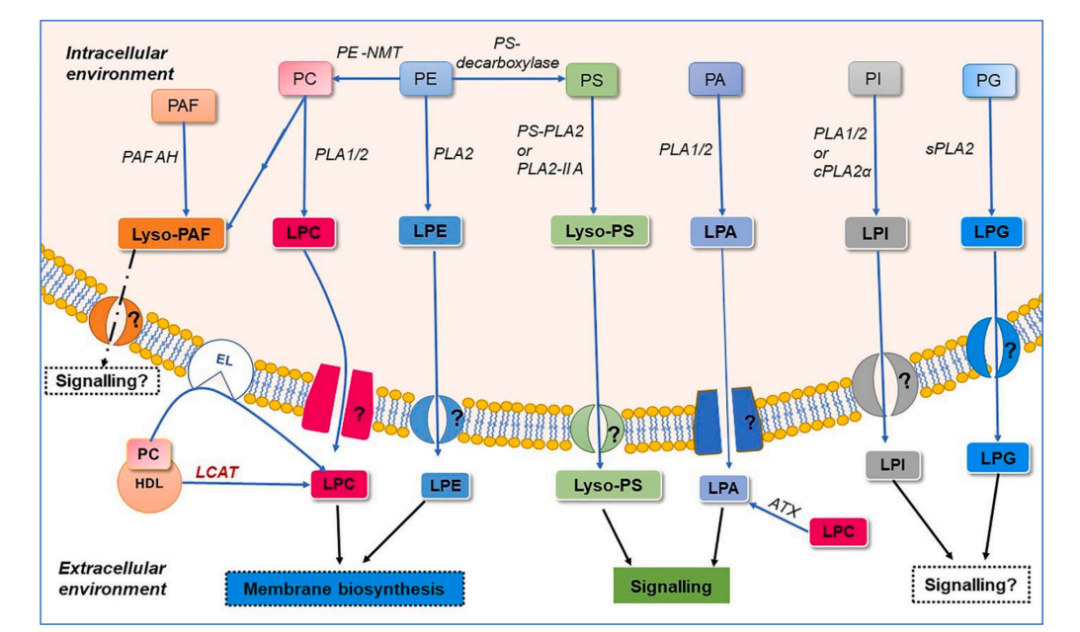
圖1.溶血磷脂合成途徑圖示
2.溶血磷脂酰乙醇胺(Lysophosphatidylethanolamine, LPE)
溶血磷脂酰乙醇胺(LPE)可以通過磷脂酶PLA2作用于細胞膜上的磷脂酰乙醇胺生成。在血液中,LPE是第二豐富的溶血磷脂,濃度范圍為10到50μM,約占總血清磷脂的1%。LPE種類包括短鏈到長鏈脂肪酸。像LPC一樣,白蛋白也是LPE在血液中的載體,但產生循環LPE的細胞類型和組織仍然未被表征。
溶血磷脂酰乙醇胺生理作用
作為信號分子:LPE能夠通過特定的受體或信號通路調節細胞功能。例如,研究表明LPE可能通過G蛋白偶聯受體(如LPA1)激活下游信號通路,導致細胞內鈣離子濃度增加和磷脂酶C(PLC)的活化。這種信號傳導機制表明LPE在調控細胞行為中可能具有重要作用。
促進細胞遷移和血管生成:LPE被發現能夠誘導人臍靜脈內皮細胞(HUVEC)的趨化遷移和管狀結構形成,這表明LPE在調節內皮細胞活性方面具有顯著作用。這些特性可能與血管生成和組織修復相關,提示LPE在傷口愈合和血管發育中的潛在功能。
免疫調節作用:盡管具體機制尚不完全清楚,但LPE可能參與免疫調節過程。例如,某些研究指出LPE可以通過激活特定受體(如LPA1或CD97)影響癌細胞的遷移和侵襲能力。此外,LPE還可能通過調節炎癥因子的釋放參與免疫反應。
神經保護和神經活性作用:LPE在神經系統中也可能發揮重要作用。例如,Grifola frondosa(一種食用菌)中的LPE被證明能夠通過激活MAPK信號通路表現出神經營養活性。這表明LPE可能在神經保護或神經再生中具有潛在應用價值。
與其他生物分子的協同作用:LPE通常與其他溶血磷脂(如LPC、LPA)共同存在于血液中,并可能通過協同作用調節多種生理過程。例如,LPE與白蛋白結合后能夠在血液中穩定存在,并可能通過這種方式調節其生物利用度。
3.溶血磷脂酸
(Lysophosphatidic acid, LPA)
溶血磷脂酸(LPA)是最簡單的溶血磷脂形式,血漿中濃度范圍為0.1-1μM,血清中可達5-10μM。LPA物種包括LPA16:0、LPA18:0、LPA18:1、LPA18:2、LPA20:4和LPA22:6。這些LPA物種可以通過兩條主要途徑合成。首先,在血小板和血漿中,溶血磷脂如LPC、Lyso-PS和LPE可以通過自分泌素(ATX,基因名為ENPP2)轉化為LPA。其次,通過磷脂酶D或二酰甘油激酶從磷脂生成的磷脂酸(PA),可以直接通過PLA1或PLA2的作用轉化為LPA。
溶血磷脂酸生理作用
分泌型PLA2-IIA(SPLA2-IIA),最初被提出是一種源自肝細胞的急性期蛋白,其在免疫防御中發揮作用,其通過與血漿膜表面上的PC結合的能力,能夠水解細胞膜,從而產生比任何其他類型的PLA2更強的殺菌效果。sPLA2-IlA特別是在病理生理條件下,誘導血小板來源的細胞外囊泡釋放LPA。這種酶通常在各種細胞受到促炎細胞因子的刺激時釋放,并在炎癥部位積累,它能夠選擇性地水解從Ca2+負載的紅細胞和激活的血小板釋放的微囊表面暴露的磷脂酸。因此,血漿中sPLA2-IIA的高濃度是炎癥性疾病中觀察到的關鍵標志物。盡管sPLA2-IIA僅對分泌的LPA占很小比例,但它可能是某些微環境中LPA積累的重要來源,特別是在炎癥部位。
循環LPA的生理作用是通過刺激LPA受體來誘導信號傳遞。目前已知有六種LPA受體(LPAR1-6),它們具有不同且部分重疊的功能。前三種LPA受體,即LPAR1-3,被歸類為內皮細胞分化基因(EDG)家族;EDG2/LPAR1、EDG4/LPAR2和EDG7/LPAR3,這些受體在組織中的分布有所不同。LPAR4-6屬于非EDG純化基因家族,與LPAR1-3在系統發育上更為遠親。作為LPC水解過程中主要的LPA生成酶,ATX的功能與LPA的信號作緊密相關。
4.溶血磷脂酰肌醇
(Lysophosphatidylinositol LPI)
LPI是一種溶血甘油磷脂,其頭部基團為肌醇。LPI主要通過磷脂酶PLA1和PLA2的作用生成,這些酶分別從甘油磷脂的sn-1和sn-2位置去除脂肪酸。在人體血漿中,LPI通常以低濃度(<0.1μM)存在,但在某些病理條件下中,其水平顯著升高至約15μM。此外,肥胖個體中也檢測到高水平的LPI,這表明其可能與肥胖相關的代謝過程有關。
溶血磷脂酰肌醇生理作用
LPI的生理功能與其在調節脂質儲存和脂肪細胞分化中的作用密切相關。研究表明,LPI通過上調脂質生成基因來促進脂質儲存,并推動前脂肪細胞向成熟脂肪細胞的分化,從而與肥胖的發生機制相關聯。此外,LPI的具體受體尚未完全明確,但已有研究提示其可能通過特定信號通路參與調控細胞活動。在胰島中刺激胰島素分泌,與胰島素協同促進細胞增殖。
編譯:伏曉曉
原文:Tan S T, Ramesh T, Toh X R, et al. Emerging roles of lysophospholipids in health and disease[J]. Progress in Lipid Research, 2020, 80: 101068.
備注:轉載只為分享,僅供學習交流為目的,如有侵權,聯系刪除。